Phép thử độc tính tế bào in vitro của các trang thiết bị y tế phải được thực hiện trên mẫu thử nào?
Phép thử độc tính tế bào in vitro của các trang thiết bị y tế phải được thực hiện trên mẫu thử nào?
Phép thử độc tính tế bào in vitro của các trang thiết bị y tế phải được thực hiện trên mẫu thử được căn cứ theo tiểu mục 4.1 Mục 4 Tiêu chuẩn quốc gia TCVN 7391-5:2020 (ISO 10993-5:2009) về Đánh giá sinh học trang thiết bị y tế - Phần 5: Phép thử độc tính tế bào in vitro như sau:
4 Chuẩn bị mẫu và đối chứng
4.1 Quy định chung
Phép thử phải được thực hiện trên:
a) dịch chiết mẫu thử và/hoặc
b) chính bản thân mẫu thử.
Chuẩn bị mẫu phải theo TCVN 7391-12 (ISO 10993-12).
Đối chứng âm tính và dương tính phải bao gồm trong mỗi xét nghiệm.
...
Theo đó, phép thử độc tính tế bào in vitro của các trang thiết bị y tế phải được thực hiện trên:
(1) Dịch chiết mẫu thử và/hoặc
(2) Chính bản thân mẫu thử.
Chuẩn bị mẫu phải theo Tiêu chuẩn quốc gia TCVN 7391-12:2023 (ISO 10993-12:2021) về Đánh giá sinh học trang thiết bị y tế - Phần 12: Chuẩn bị mẫu và mẫu chuẩn.
Đối chứng âm tính và dương tính phải bao gồm trong mỗi xét nghiệm.
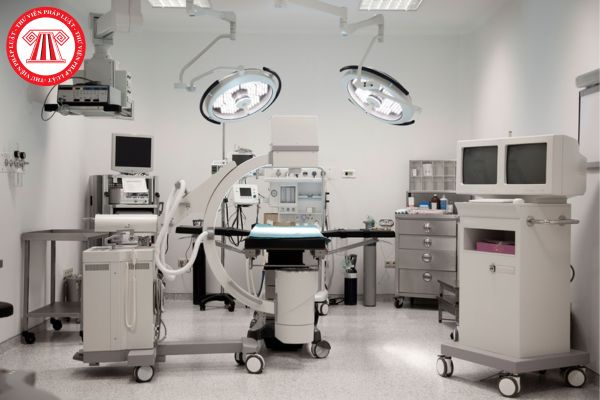
Phép thử độc tính tế bào in vitro của các trang thiết bị y tế phải được thực hiện trên mẫu thử nào? (Hình từ Internet)
Việc chiết mẫu thử độc tính tế bào in vitro của các trang thiết bị y tế cần đảm bảo nguyên tắc ra sao?
Việc chiết mẫu thử độc tính tế bào in vitro của các trang thiết bị y tế cần đảm bảo nguyên tắc được căn cứ theo tiết 4.2.1 tiểu mục 4.2 Mục 4 Tiêu chuẩn quốc gia TCVN 7391-5:2020 (ISO 10993-5:2009) về Đánh giá sinh học trang thiết bị y tế - Phần 5: Phép thử độc tính tế bào in vitro như sau:
Các điều kiện chiết nên cố gắng mô phỏng hoặc khuyếch tán các điều kiện sử dụng lâm sàng để xác định nguy cơ độc tính tiềm tàng mà không gây ra thay đổi đáng kể trong mẫu thử, như phản ứng tổng hợp, tan chảy hoặc bất kỳ thay đổi nào của cấu trúc hóa học, trừ khi điều này được dự kiến trong ứng dụng lâm sàng.
Do bản chất của các vật liệu nhất định (ví dụ: vật liệu phân hủy sinh học), sự thay đổi cấu trúc hóa học có thể xảy ra trong quá trình chiết.
CHÚ THÍCH:
+ Nồng độ của bất kỳ chất nội sinh hoặc ngoại lai nào trong dịch chiết, và do đó lượng tiếp xúc với các tế bào thử nghiệm, phụ thuộc vào vùng giao thoa, thể tích chiết, pH, độ hòa tan hóa học, tốc độ khuếch tán, độ thẩm thấu, khuấy trộn, nhiệt độ, thời gian và các yếu tố khác các yếu tố.
+ Đối với các trang thiết bị liên quan đến việc trộn hai hoặc nhiều thành phần trong bệnh nhân để đến trang thiết bị cuối cùng (ví dụ xi măng xương), không nên rửa trang thiết bị cuối cùng trước khi chiết. Rửa mẫu thử có thể làm giảm hoặc loại bỏ cặn có trên trang thiết bị. Nếu mẫu thử được sử dụng trong môi trường vô khuẩn, nên sử dụng mẫu thử tiệt trùng để chiết các thành phần hóa học.
Điều kiện chiết mẫu thử độc tính tế bào in vitro của các trang thiết bị y tế quy định thế nào?
Điều kiện chiết mẫu thử độc tính tế bào in vitro của các trang thiết bị y tế được căn cứ theo tiết 4.2.3 tiểu mục 4.2 Mục 4 Tiêu chuẩn quốc gia TCVN 7391-5:2020 (ISO 10993-5:2009) về Đánh giá sinh học trang thiết bị y tế - Phần 5: Phép thử độc tính tế bào in vitro như sau:
- Việc chiết phải được thực hiện trong các vật chứa vô khuẩn, trơ về mặt hóa học, đóng kín bằng cách sử dụng các kỹ thuật vô khuẩn, theo TCVN 7391-12 (ISO 10993-12).
- Ngoại trừ các trường hợp được nêu dưới đây, việc chiết phải được tiến hành theo một trong các điều kiện sau và phải được áp dụng theo các đặc trưng của trang thiết bị và điều kiện cụ thể để sử dụng:
+ (24 ± 2) h ở (37 ± 1) °C;
+ (72 ± 2) h ở (50 ± 2) °C;
+ (24 ± 2) h ở (70 ± 2) °C;
+ (1 ± 0,2) h ở (121 ± 2) °C.
Lưu ý:
++ Các điều kiện chiết được mô tả ở trên, đã được sử dụng để cung cấp thước đo về khả năng gây nguy hiểm cho việc ước tính rủi ro của trang thiết bị hoặc vật liệu, dựa trên tiền lệ lịch sử.
++ Các điều kiện khác, ví dụ: thời gian chiết kéo dài hoặc rút ngắn ở 37 °C, mô phỏng quá trình chiết xảy ra trong quá trình sử dụng lâm sàng hoặc cung cấp một thước đo đầy đủ về khả năng gây nguy hiểm, có thể được sử dụng, nhưng phải được chứng minh và ghi lại.
++ Đối với các trang thiết bị y tế tiếp xúc ngắn hạn (thời gian tiếp xúc tích lũy không quá 4 h) với da hoặc niêm mạc còn nguyên vẹn và không được cấy ghép, điều này có thể bao gồm thời gian chiết dưới 24 h nhưng không dưới 4 h, như đã nêu trong a) đến c).
++ Môi trường nuôi cấy tế bào với huyết thanh chỉ nên được sử dụng theo a) vì nhiệt độ chiết lớn hơn (37 ± 1) °C có thể ảnh hưởng xấu đến hóa học và/hoặc tính ổn định của huyết thanh và các thành phần khác trong môi trường nuôi cấy.
++ Đối với các mẫu thử polyme, nhiệt độ chiết không được vượt quá nhiệt độ chuyển thủy tinh vì nhiệt độ cao hơn có thể thay đổi thành phần dịch chiết.
- Nếu dịch chiết được lọc, ly tâm hoặc xử lý bằng các phương pháp khác trước khi áp dụng cho các tế bào, các chi tiết này phải được ghi lại trong báo cáo cuối cùng cùng với lý do cho các bước bổ sung (xem Điều 9). Bất kỳ điều chỉnh pH của dịch chiết phải được báo cáo. Cần tránh thao tác chiết, chẳng hạn như điều chỉnh pH, vì nó có thể ảnh hưởng đến kết quả.









Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Từ chối chứng từ chứng nhận xuất xứ hàng hóa trong trường hợp nào? Từ chối chứng từ chứng nhận xuất xứ hàng hóa trong Hiệp định CPTPP ra sao?
- Trọng tài quy chế là gì? Nguyên đơn làm đơn khởi kiện có được áp dụng giải quyết tranh chấp bằng trọng tài quy chế không?
- Kiểm tra chứng từ đối với chứng từ tự chứng nhận xuất xứ hàng hóa nhập khẩu được thực hiện thế nào?
- Có được tự chế bình xịt hơi cay mini tự vệ vào ban đêm không? Trang bị bình xịt hơi cay bên người có bị phạt không?
- Kết thúc xây dựng Khu kinh tế quốc phòng là gì? Kết thúc xây dựng Khu kinh tế quốc phòng trong trường hợp nào?









